مقاله شیمی
مقاله_-_L_مطالعه_تخريب_حرارتي_در_سنتز_پليلاكتايد_به_روش_پليمر_شدن_.pdf
مقاله_Aspergillus_بررسي_توليد_لواستاتين_از_سويه.pdf
مقاله_GM-CSF_بهينه_سازي_توليد_ترشحی.PDF
مقاله_SCP_بررسی_وضعيت_توليد_و_مصرف.PDF
مقاله_آماده_سازي_و_ويژگي_هاي_لومينسنس_يك_فسفر.pdf
مقاله_اثر_متغيرهاي_فرآيند_پرتودهي_روي_استحكامبه_UHMWPE_PET_كششي_و_.pdf
مقاله_ارائه_روش_موثر_جهت_بازيابي_و_جلوگيري_از_دور_ريز.pdf
مقاله_ارزيابي_عملکرد_باکتريهای_جداسازی_شده_از_مخاز_ن.PDF
مقاله_ارزيابي_نحوه_و_روند_انتشار_آلاينده_هاي_هوا_در.pdf
مقاله_از_آب_و_خاك_آلوده_MTBE_روشهاي_حذف.pdf
مقاله_از_باگاس_نيشكر_(_Biooil_)_توليد_زيست_سوخت.pdf
مقاله_ازمنابع_آب_MTBE_بررسي_حذف_ماده_آلاينده.pdf
مقاله_استفاده_از_تكنولوژي_آنزيم_در_فرآوري_خمير.pdf
مقاله_استفاده_از_روش_افزايش_بيولوژيکي_در_تصفيهپساب_کارخانجات_لبنيا.pdf
مقاله_استفاده_از_شروع_كننده_هاي_دو_عاملي_درپليمريزاسيون_راديكالي.pdf
مقاله_اصلاح_خواص_فيزيكي_و_مكانيكي_سيستم_هاي_برپايه_گل_رس_با_استفاد.pdf
مقاله_اصلاح_شيميايي_ساختار_پليمر_ليفياكريلونيتريل_با_استفاده_از_تر.pdf
مقاله_اصلاح_شيميايي_ساختار_پليمر_ليفياكريلونيتريل_با_استفاده_از_تر.pdf
مقاله_اصلاح_پليمري_كامپوزيت_هاي_بر_پايه_گل_رس.pdf
مقاله_اصلاح_چسبندگي_پلي_يورتان_به_سيليكون_رابر.pdf
مقاله_انتخاب_مدلهاي_سينتيكي_مناسب_براي_بررسي_رشد.pdf
مقاله_اندازه_گيری_غلظت_سلولی_و_تعيين_کيفيت_آن.PDF
مقاله_اولوي_تهاي_بهر_هگيري_از_نانوفناوري.PDF
مقاله_بازده_حذف_بنزن_در_پسابهاي_پتروشيمي_با_فرآيند.pdf
مقاله_بازيابي_آب_كلردار_واحد_كلرآلكالي_شركت_كيميايپتروشيمي_بندراما.pdf
مقاله_بازيابي_پلاتين_از_كاتاليزورهاي_مستعمل_واحد_ريفورمينگ.pdf
مقاله_بر_مورفولوژي_و_(_PVP_)_اثر_پلي_وينيل_پيروليدونغشاء_(_Support.pdf
مقاله_بررسي_آميزه_پلي_وينيل_کلرايد_اکريلونيتريلجهت_تهيه_کاغذ_(PVCN.pdf
مقاله_بررسي_اثر_پارامتر_هاي_مختلف_بر_پليمريزاسيونبه_روش_طراحي_THT_.pdf
مقاله_بررسي_اثرشوك_حرارتي_برروي_پروتئين_تك_ياختهاز_آب_پنير.pdf
مقاله_بررسي_احتمال_تغيير_جرم_مولكولي_متوسط_وزنييك_نمونه_پلي_اكسي_ا.pdf
مقاله_بررسي_ايزومري_شدن_آنزيمي_گلوكز_به_فروكتوز_دريك_جت_راكتور_با_.pdf
مقاله_بررسي_تأثير_فرمولاسيون_و_شرايط_فرآيند.PDF
مقاله_بررسي_تأثير_نسبت_مولي_آلومينيم_به_تيتانيم_درپليمريزاسيون_اتي.pdf
مقاله_بررسي_تأثير_پايدارکننده_ها_و_روان_کننده_ها_برروي_ميزان_فيوژن.pdf
مقاله_بررسي_تاثير_پارامترهاي_موثر_بر_تغيير_رنگ_شربتگلوکز_در_حين_نگ.pdf
مقاله_بررسي_توليد_فيبر_خوراكي_از_تفاله_صنايع.PDF
مقاله_بررسي_جذب_بيولوژيكي_جهت_جداسازي_فلزاتسنگين_از_پسابها-_مو_(1).pdf
مقاله_بررسي_جذب_بيولوژيكي_جهت_جداسازي_فلزاتسنگين_از_پسابها-_مورد_د.pdf
مقاله_بررسي_خواص_فيزيكي_و_مكانيكي_سيستم_گل_رس.pdf
مقاله_بررسي_سينتيك_واكنش_پليمريزاسيون_راديكاليدر_حضور_آغازگر_(MMA).pdf
مقاله_بررسي_عملکرد_وينيل_تري_متوکسي_سيلان_دربهبود_چسبندگي_روکشهاي_.pdf
مقاله_بررسي_عوامل_مؤثر_در_توليد_نانوذرات.pdf
مقاله_بررسي_فرايند_احياي_سولفات_باريم_به_روش_طراحي.pdf
مقاله_بررسي_مقاومت_به_تركزايي_تنشي_محيطي.PDF
مقاله_بررسي_مقاومت_روغني_و_حرارتي_و_سينتيك_نفوذNBRCR_و_آلياژ_CR_،N.pdf
مقاله_بررسي_مكانيزم_انتقال_به_هوا_در_فرايند_حذفبيولوژيكي_اتيل_بنزن.pdf
مقاله_بررسي_ميزان_اتصال_متوكسي_پلي_اتيلن_گليكولفعال_شده_به_سطح_سلو.pdf
مقاله_بررسي_هيدروژل_هاي_حساس_به_دماي_زيستتخريب_پذير_با_پايه_كيتوسا.pdf
مقاله_بررسي_و_آناليز_عناصر_فلزي_سنگين_در_آبهايو_ppb_آشاميدني_مناطق.pdf
مقاله_بررسي_و_بهينه_سازي_اثرات_متقابل_ضريباصطكاك،_چسبندگي_و_چاپ_پذ.pdf
مقاله_بررسي_و_طراحي_سيستم_مناسب_جلوگيري_ازپلي_اتيلن_HD_انتشار_غبار.pdf
مقاله_بررسي_و_مطالعه_حلاليت_دي_اكسيد_كربن_در_حلا_لهاي_آلي_در_دماها.pdf
مقاله_بررسي_وتعيين_خواص_فيزيكي_آب_پنير_جهتاستفاده_در_طراحي_واحدهاي.pdf
مقاله_بررسي_پارامتر_هاي_عملياتي_بر_ثابت_سرعتوسينتيك_خشك_كردن_سيب.pdf
مقاله_بررسي_پتانسيل_اسيدهاي_آمينه_بعنوان_تنها_منبعكربن_و_نيتروژن_د.pdf
مقاله_بررسی_اثر_تغلیظ_اکسیژن_هوا.PDF
مقاله_بررسی_سطح_جذبی_هیدرو_کربنها.PDF
مقاله_بررسی_مکانيزم_انتقال_جرم_در_حين_تشکيل_قطره.PDF
مقاله_بكارگيري_روش_طراحي_آزمايش_تاگوچي_جهتبهينه_سازي_شرايط_رنگبري_.pdf
مقاله_بهينه_سازي_ساختارهاي_ساندويچي_بكار_رفته_در_هوا_فضا.pdf
مقاله_بهينه_سازي_شرايط_عملياتي_سيستم_لجن_فعال_و.pdf
مقاله_بيوتكنولوژي_راهكاري_براي_حذف_تركيبات_مزاحمنيتروژني_از_خوراك_.pdf
مقاله_بيوهيدرومتالورژي_انتخابي_برتر_در_اقتصاد.pdf
مقاله_تأثير_جيبرليك_اسيد_و_سبوس_برنج_بر_توليد_اتانولز_ملاس_و_شربت_.pdf
مقاله_تاثير_آمونياک_بر_گرانولاسيون_لجن_بي_هوازي.pdf
مقاله_تاثير_دما_در_بهينه_سازي_مرحله_تخمير_اكسيداتيودر_فرآيند_توليد.pdf
مقاله_تاثير_روشهاي_مختلف_فرآوري_روي_پايداري_حالتابري_آب_هويج.pdf
مقاله_تاثير_متغيرهاي_عملياتي(شدت_جريان_فازها_وشدت_ضربان)_و_انتقال_.pdf
مقاله_تاثير_مقدار_زيركونيم_روي_عملكرد_كاتاليست_كبالت.pdf
مقاله_تاثير_منبع_کربن_و_نيتروژن_بر_عملکرد_فنوکارئت_کرايزسپريوم_در_.pdf
مقاله_تاثيراستفاده_همزمان_از_دو_آغازگربروزن_مولكولي.pdf
مقاله_تبديل_مستقيم_دی_اکسيد_کربن_دردماي_پائين.PDF
مقاله_تبيين_روشي_جديد_در_فرايند_هيدروليز_متيل.pdf
مقاله_تحليل_رياضي_و_تجربي_بيوراکتور_بستر_ثابت_گلوکزايزومراز_تثبيت_.pdf
مقاله_تخريب_پذير_نمودن_زيست_محيطي_پلي_اتيلن.pdf
مقاله_ترمودینامیک_سطح_محلول_های_پلیمری.PDF
مقاله_تصفيه_آب_نمك_چرخشي_در_كارخانة_توليد_نمكجهت_كاهش_املاح_كلسيم_.pdf
مقاله_تصفيه_الكتروشيميايي_پسابهاي_رنگي_در_محيط_آبي_وبررسي_اثر_ولتا.pdf
مقاله_تعيين_شرايط_بهينه_توليد_بيوسورفكتانت_ها_بهمنظور_استفاده_در_ت.pdf
مقاله_تعيين_ميزان_لاستيك_مقيد_به_عنوان_معياري_ازبا_آلياژ_هاي_N_و_6.pdf
این مطلب در تاریخ: چهار شنبه 11 دی 1392 ساعت: 5:7 منتشر شده است
برچسب ها : مقاله شیمی,





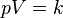
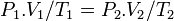
 فشار گاز ایدهآل در قبل از فرآیند
فشار گاز ایدهآل در قبل از فرآیند حجم گاز ایدهآل در قبل از فرآیند
حجم گاز ایدهآل در قبل از فرآیند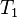 دمای گاز ایدهآل در قبل از فرآیند
دمای گاز ایدهآل در قبل از فرآیند فشار گاز ایدهآل در بعد از فرآیند
فشار گاز ایدهآل در بعد از فرآیند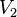 حجم گاز ایدهآل در بعد از فرآیند
حجم گاز ایدهآل در بعد از فرآیند دمای گاز ایدهآل در بعد از فرآیند
دمای گاز ایدهآل در بعد از فرآیند
.gif)
.jpg)
.gif)






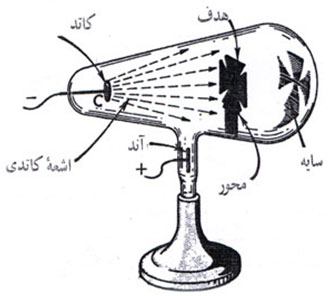
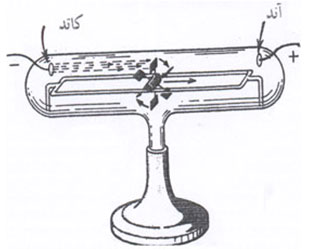
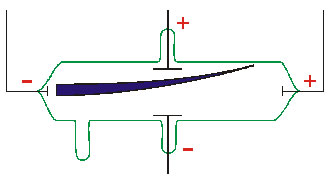
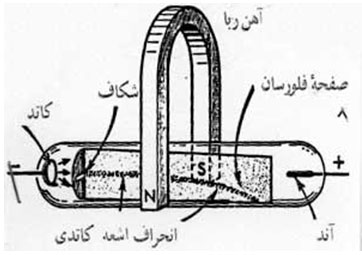
 را ایجاد میکنند.
را ایجاد میکنند.